Einführung
Da die meisten Biopharmazeutika in aeroben Prozessen hergestellt werden, ist die richtige Sauerstoffversorgung der Zellen von entscheidender Bedeutung und eine häufige Herausforderung sowohl bei Zellkulturen als auch bei mikrobiellen Anwendungen. Bei der Belüftung von Bioreaktoren wird Sauerstoff aus der Gasphase in die flüssige Phase überführt (d. h., die Sauerstoffmoleküle gehen in einen gelösten Zustand über). Sobald der Sauerstoff gelöst ist, kann er von den Zellen aufgenommen und verwertet werden. Es muss sichergestellt werden, dass die Geschwindigkeit, mit der Sauerstoff aus der Gasphase in die flüssige Phase übertragen wird (die Sauerstofftransferrate (engl. OTR)), die Geschwindigkeit übersteigt, mit der Sauerstoff von den Zellen verbraucht wird (die Sauerstoffaufnahmerate (engl. OUR)). Wenn das Sauerstoffangebot begrenzt ist oder die Sauerstoffkonzentrationen schwanken, kann sich die Wachstumsrate der Zellen verringern, was zu Veränderungen im Zellstoffwechsel und schließlich zu einer geringeren Produktbildungsrate führen kann (Seidel et al. 2021). Die OTR in einem Bioreaktorsystem kann durch die folgende Gleichung beschrieben werden:

Wo:
OTR = Sauerstofftransferrate (mol/(m3 ∙ h))
kL = Gasübergangskoeffizient (m/h)
a = Oberfläche der Gas-Flüssigkeits-Grenzfläche pro Flüssigkeitsvolumen (m2/m3)
CO2 (l)* = Konzentration (C) von Sauerstoff (O2) in der Flüssigkeit (l) (mol/m3)
CO2 (l) = tatsächliche Sauerstoffkonzentration in der Flüssigkeit (DO) (mol/m3)
CO2(l)* – CO2(l) = Konzentrationsgefälle oder treibende Kraft (mol/m3)
Die OTR wird von einer Vielzahl von Faktoren beeinflusst, wie z. B. der Grösse und der Konfiguration des Bioreaktorbehälters und bestimmter Hilfsmittel (z. B. Reaktorvolumen, Reaktorgeometrie, Impellertyp und -durchmesser, Sparger-Typ), der Konfiguration und den Einstellungen der zur Verbesserung des Gastransfers verwendeten Geräte (z. B., Rührergeschwindigkeit, Luftstrom), die physikalische Umgebung im Bioreaktorsystem (z. B. Temperatur, Druck), das Vorhandensein oder Fehlen bestimmter Verbindungen im Kultivierungsmedium (z. B. Proteine, Tenside, Salze) oder die Zellen im Kultivierungsmedium (z. B. Zelldichte, Zellmorphologie) (Abbildung 1) (Garcia-Ochoa und Gomez 2009).
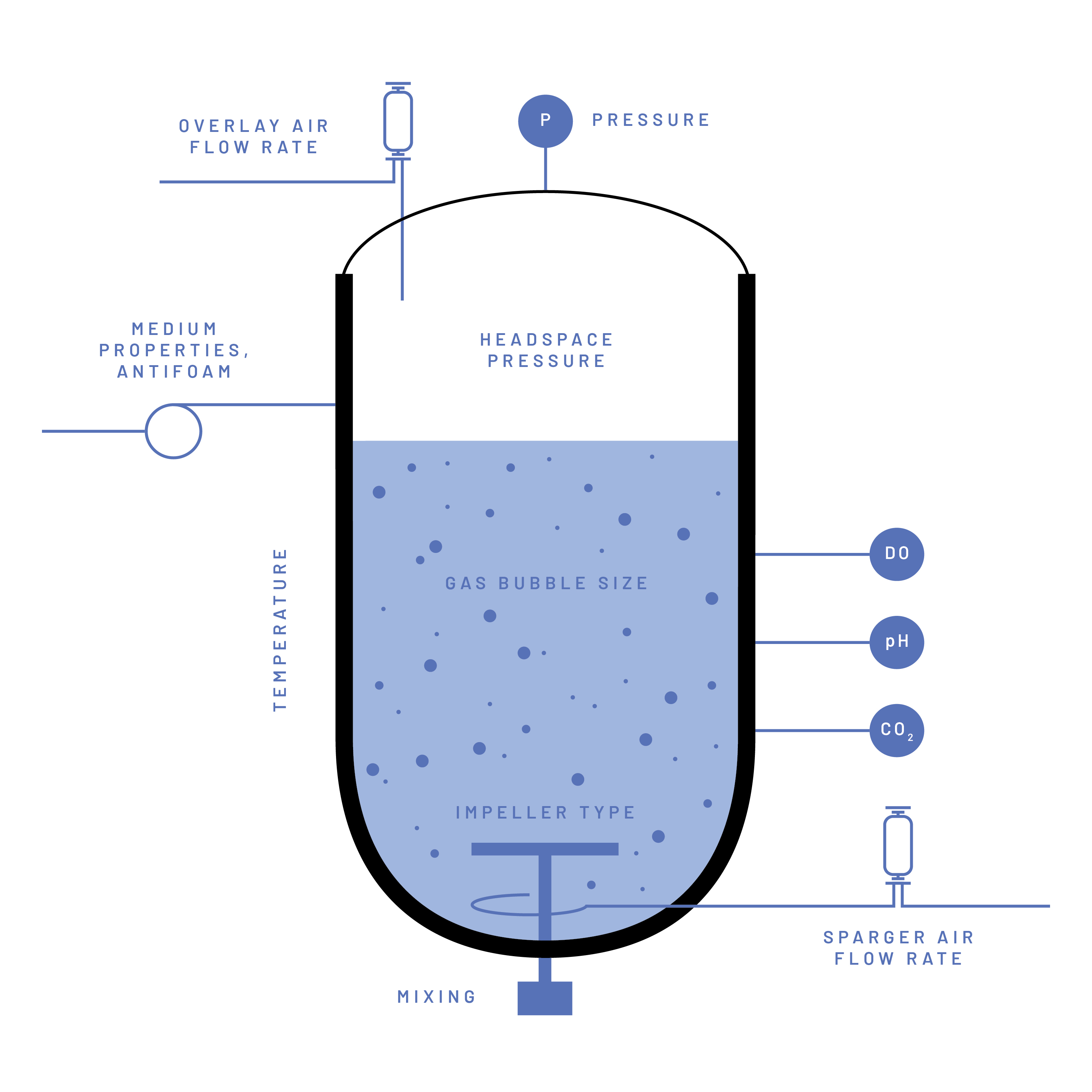
Da zahlreiche Faktoren die OTR beeinflussen, ist es in der Biotechnologie gängige Praxis, die Sauerstofftransfereffizienz speziell für das Bioreaktorsystem und die jeweiligen Prozessbedingungen zu bewerten. Diese Bewertung beinhaltet in der Regel die experimentelle Bestimmung des kLa-Parameters, eines umfassenden Parameters, der die Parameter "kL" und "a" der OTR-Gleichung kombiniert. kL" steht für die Moleküldiffusionsrate durch die Gas-Flüssigkeits-Grenzfläche und "a" für die Fläche dieser Grenzfläche pro Flüssigkeitsvolumen (Abbildung 2). Der kLa wird in reziproken Zeiteinheiten (h-1) ausgedrückt. Der kLa-Wert gibt die Gasübertragungskapazität innerhalb des Systems an und definiert die Grenzen eines bestimmten Bioprozesses (OTRmax). Anhand dieser Information lässt sich feststellen, ob ein Bioprozess von vornherein sauerstoffbegrenzt ist, was bei der Optimierung und dem Upscaling eines beliebigen aeroben Bioprozesses von Bedeutung sein kann.
Es gibt verschiedene Methoden zur experimentellen Bestimmung des kLa-Wertes, z. B. die Sulfit-Oxidationsmethode, die statische Ausgasungsmethode, die dynamische (Ausgasungs-)Methode und die Sauerstoffbilanzmethode (Vanags und Suleiko 2022). In der Literatur werden diese Methoden nicht immer einheitlich benannt. In diesem Artikel übernehmen wir die Terminologie von Vanags und Suleiko (2022), und die hier beschriebene Methode basiert auf der Methode des statischen Ausgasens.
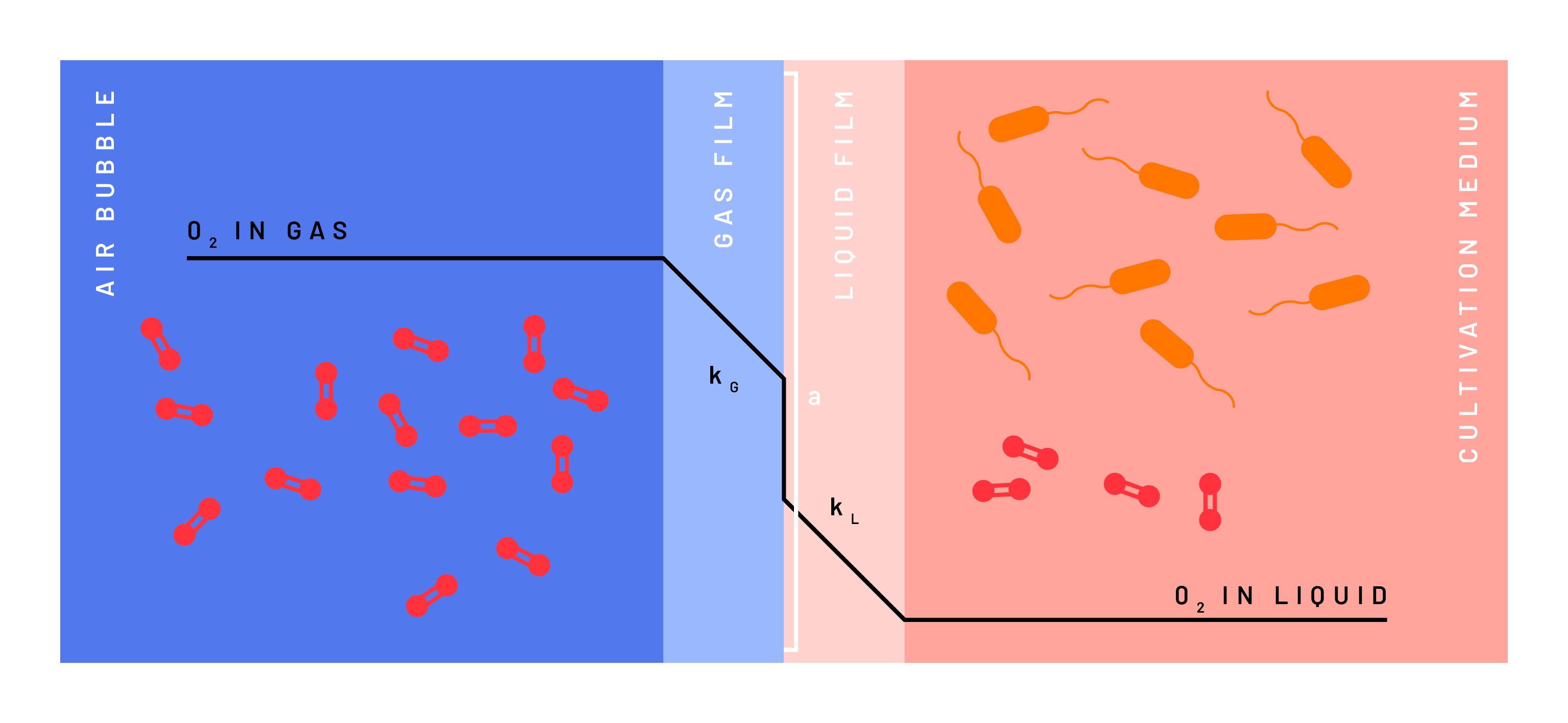
Statische Ausgasungsmethode
Die statische Ausgasungsmethode wurde erstmals von Wise (1951) beschrieben und wird heute häufig zur Charakterisierung des Sauerstofftransfers in verschiedenen Bioreaktorsystemen verwendet. Bei der statischen Ausgasungsmethode wird die Konzentration des gelösten Sauerstoffs im Medium mit einem Sauerstoffsensor gemessen. Der Bioreaktor wird mit einem beliebigen flüssigen Medium gefüllt. Die Sauerstoffkonzentration des Mediums wird durch Entgasung mit Stickstoff auf Null gesetzt. Danach erfolgt die Belüftung unter Prozessbedingungen (mit einer definierten Belüftungsrate und Rührerdrehzahl). Durch die Überwachung der Konzentration des gelösten Sauerstoffs über die Zeit kann die Geschwindigkeit, mit der das Gas von der Gasphase in die flüssige Phase übergeht, quantifiziert und die kLa bestimmt werden (Wise 1951).
Bei der statischen Ausgasungsmethode wird angenommen, dass die Gleichgewichtskonzentration des gelösten Sauerstoffs CO2(l)* während der Sauerstoffanreicherung des Mediums konstant ist. Die Steigung der resultierenden Kurve ist dann gleich -kLa (Abbildung 3).
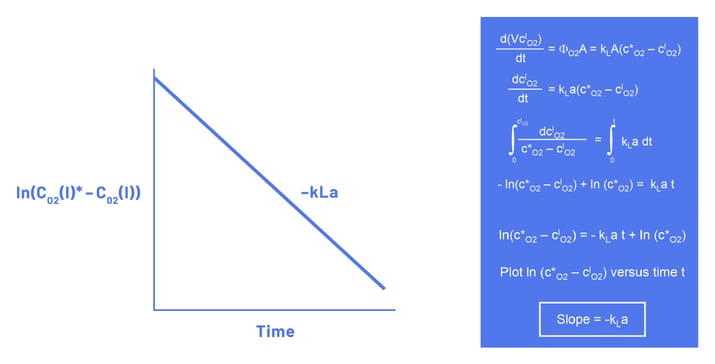
Da die statische Ausgasungsmethode davon ausgeht, dass sich die flüssige Phase in einem vollständigen Gleichgewicht mit der Gasphase befindet (CO2(l)* = konstant), ist diese Methode für kleine Bioreaktoren genauer als für große Bioreaktoren. In großen Bioreaktoren ist es aufgrund des relativ größeren Flüssigkeitsvolumens und des kleineren Verhältnisses von Oberfläche zu Volumen schwieriger, ein Gleichgewicht zu erreichen. Obwohl Korrekturfaktoren abgeleitet wurden, um dieses Phänomen zu kompensieren, kamen Van't Riet und Tramper (1991) zu dem Schluss, dass die statische Ausgasungsmethode nicht für Gefäße mit einer Höhe von mehr als einem Meter verwendet werden sollte (Van't Riet und Tramper 1991).
Die experimentelle Bestimmung des kLa-Parameters ist ein aufwendiger Prozess, der die folgenden Aufgaben umfasst:
-
Vorbereiten des Bioreaktorsystems: Dieser Schritt erfordert eine physische Vorbereitung des Bioreaktorsystems, die bei der Arbeit mit nährstoffreichen Medien oft eine Autoklavierung erfordert, um die Sterilität zu gewährleisten.
-
Durchführung des Experiments: In dieser Phase muss die Steuerung des Bioreaktors mit den richtigen Parametern konfiguriert werden. Darüber hinaus umfasst dieser Schritt die Aktivierung der Datenprotokollierung für die wichtigsten Prozessparameter in der SCADA-Software, die ständige Überwachung des/der Laufs/Läufe und den Export der gesammelten Daten für die anschließende Analyse.
-
Datenverarbeitung: Nach dem Experiment ist eine manuelle Datenverarbeitung erforderlich. Dazu gehört die Verwendung von Software wie Excel zur Durchführung von Berechnungen und zur Ableitung des/der erforderlichen kLa-Werts/e aus den Rohdaten.
Die hier beschriebene Anwendung zur kLa-Bestimmung reduziert den Zeit- und Arbeitsaufwand für die Evaluation der kLa-Werte drastisch, da die oben beschriebenen Schritte (2) und (3) vollständig automatisiert werden.
Materialien und Methoden
Für die Automatisierung der kLa-Bestimmung wurde in Lucullus® eine eigene Prozesssteuerung geschrieben. Die Operation ist kompatibel mit Lucullus® Versionen 3.10.5 und höher. Die Operation enthält einen Algorithmus in Form einer Schrittkette und zwei komplementäre Skripte. Die Schrittkette besteht aus mehr als 60 Einzelschritten, die miteinander verknüpft sind, um die korrekte Durchführung des kLa-Bestimmungsexperiments zu ermöglichen (Abbildung 4).
Funktionell lässt sich die Schrittkette in zwei verschiedene Teile unterteilen:
-
Der erste Teil der Schrittkette konzentriert sich auf die Initialisierung des Experiments für die kLa-Bestimmung. Er enthält mehrere einzelne Schritte, die durch blaue Überschriften gekennzeichnet und mit einem Lucullus®-Pop-up-Fenster verbunden sind. Die Pop-up-Fenster ermöglichen es dem Benutzer, die erforderlichen Informationen manuell einzugeben. Die Navigation durch diesen ersten Abschnitt der Schrittkette kann innerhalb von 10 Minuten erledigt werden.
-
Der zweite Teil der Schrittkette ist vollständig automatisiert und führt das eigentliche kLa-Bestimmungsexperiment durch. Je nach den vom Benutzer gewählten experimentellen Einstellungen und der spezifischen Art und Größe des Bioreaktors kann sich dieser Vorgang über Stunden oder sogar Tage hinziehen. Dieser Teil der Schrittkette umfasst die folgenden Funktionen: Sicherstellen der Temperaturstabilität, Desoxygenierung des Reaktors mit N2-Gas, Sauerstoffanreicherung des Reaktors mit Luft, Sammeln von Daten des DO-Sensors, Durchlaufen der experimentellen Einstellungen und Berechnung der (durchschnittlichen) kLa-Werte.
Die hier vorgestellten Daten wurden mit zwei my-Control-Steuerungen (Getinge Applikon) und zwei 500-mL-miniBio-Bioreaktoren ("Grün" und "Blau") (Getinge Applikon) an der Wageningen University & Research (WUR) in Wageningen, Niederlande, gesammelt. Beide Bioreaktoren waren mit einem einzelnen Schiffsimpeller (Vortex, 28 mm Durchmesser) und einem L-förmigen Sparrer ausgestattet. Die Reaktoren wurden mit 300 mL Wasser gefüllt und vor Beginn der Versuche auf 20 °C aufgeheizt. N2-Gas und Luft wurden mit Hilfe von Massendurchflussreglern (MFCs) zugeführt, die in die my-Control-Steuergeräte eingebaut waren. Der gelöste Sauerstoff wurde mit einem LumiSens DO-Sensor (Getinge Applikon) gemessen.
Um die Möglichkeiten des kLa-Bestimmungsvorgangs zu demonstrieren, wurden vier verschiedene Experimente durchgeführt:
-
Variation von Luftstrom und Rührerdrehzahl. Dieser Versuch wurde mit insgesamt 10 verschiedenen Einstellungen für den Luftstrom durchgeführt, beginnend bei 25 mL/min und schrittweise erhöht um 25 mL/min bis 250 mL/min. In ähnlicher Weise wurden 10 verschiedene Einstellungen für die Rührerdrehzahl getestet, beginnend bei 100 U/min und schrittweise erhöht um 100 U/min bis 1000 U/min. Insgesamt wurden 100 verschiedene Kombinationen von Luftstrom und Rührerdrehzahl getestet. Jede einzelne Einstellungskombination wurde dreimal wiederholt, so dass insgesamt 300 Durchläufe pro Reaktor durchgeführt wurden.
-
Variation von Reaktor zu Reaktor. Dieses Experiment wurde mit zwei miniBio-Bioreaktoren mit völlig identischem Hardware-Layout durchgeführt. Für den Luftstrom wurden 3 verschiedene Einstellungen getestet: 50 mL/min, 100 mL/min und 150 mL/min. Für die Rührerdrehzahl wurden 3 verschiedene Einstellungen getestet: 250 rpm, 500 rpm und 750 rpm. Insgesamt wurden 9 verschiedene Kombinationen von Luftstrom und Rührerdrehzahl getestet. Jede einzelne Einstellungskombination wurde dreimal wiederholt, so dass insgesamt 27 Läufe pro Reaktor durchgeführt wurden.
-
Temperaturschwankungen. Dieses Experiment wurde mit zwei Temperatureinstellungen durchgeführt: 20 °C und 37 °C. Für den Luftstrom wurden 3 verschiedene Einstellungen getestet: 50 mL/min, 100 mL/min und 150 mL/min. Für die Rührerdrehzahl wurden 3 verschiedene Einstellungen getestet: 250 rpm, 500 rpm und 750 rpm. Insgesamt wurden 9 verschiedene Kombinationen von Luftstrom und Rührerdrehzahl getestet. Jede einzelne Einstellungskombination wurde dreimal bei 20 °C und 37 °C wiederholt, so dass insgesamt 54 Durchläufe pro Reaktor durchgeführt wurden.
-
Variation der Rührerkonfiguration. Dieser Versuch wurde mit zwei verschiedenen Drehrichtungen des Rührers durchgeführt, wobei derselbe Marine Impeller verwendet wurde: im Uhrzeigersinn und gegen den Uhrzeigersinn (wobei der Marine Impeller als Vortex- bzw. Scoping-Impeller eingesetzt wurde). Für den Luftstrom wurden 3 verschiedene Einstellungen getestet: 50 mL/min, 100 mL/min und 150 mL/min. Für die Rührerdrehzahl wurden 3 verschiedene Einstellungen getestet: 250 rpm, 500 rpm und 750 rpm. Insgesamt wurden 9 verschiedene Kombinationen von Luftstrom und Rührerdrehzahl getestet. Jede einzelne Einstellungskombination wurde dreimal mit demselben Schiffsflügelrad im und gegen den Uhrzeigersinn wiederholt, so dass sich insgesamt 54 Durchläufe pro Reaktor ergaben.
Nach der Konfiguration der experimentellen Einstellungen in Lucullus® wurden die Experimente so eingestellt, dass sie autonom, d.h. ohne Aufsicht, ablaufen. Nach dem Experiment beendete Lucullus® automatisch die kLa-Erfassung. Die Versuchsdaten wurden dann nach Excel exportiert (Abbildung 5-8).
Ergebnisse und Diskussion
Die vier Experimente zur Prüfung von (1) Luftstrom- und Rührerdrehzahlvariationen, (2) Reaktor-zu-Reaktor-Variationen, (3) Temperaturvariationen und (4) Variationen der Rührerkonfiguration wurden am WUR abgeschlossen. Für alle vier Versuchsaufbauten lag die Erfolgsquote der kLa-Berechnung bei 100 %. Für jede einzelne Bedingung (3-mal wiederholt) wurde der durchschnittliche kLa-Wert mit der entsprechenden Standardabweichung berechnet. Die Schwankung der kLa-Werte zwischen den Wiederholungen der gleichen Bedingung war gering, insbesondere bei niedrigeren Luftdurchsätzen und Rührerdrehzahlen mit Standardabweichungen von 0,01 h-1. (Tabelle 2, Anhang).
Experiment 1 (Variation des Luftstroms und der Rührerdrehzahl)
Versuch 1 wurde innerhalb von 114 Stunden für Reaktor "Blau" und 90 Stunden für Reaktor "Grün" abgeschlossen. Die in Abbildung 5 dargestellten Ergebnisse zeigen die kLa-Werte, die mit dem Reaktor "Grün" ermittelten wurden. Wie erwartet, steigt der kLa mit zunehmendem Luftstrom und zunehmender Rührerdrehzahl. Die Ergebnisse für den Reaktor "Blau" sind im Anhang dargestellt.
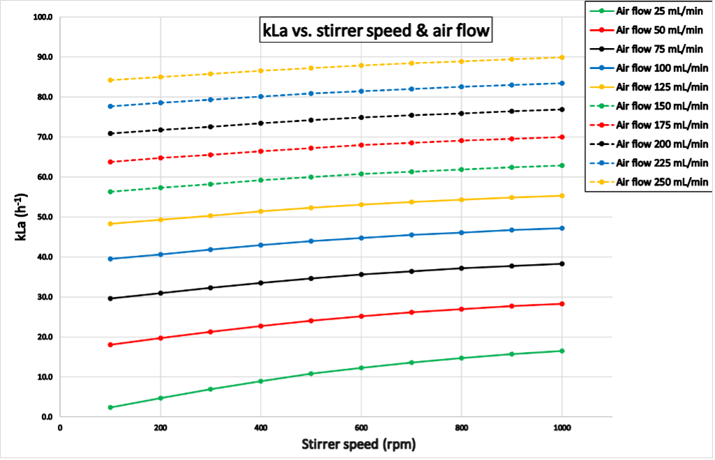 Abbildung 5: Ergebnisse aus Versuch 1 für Reaktor "Grün": kLa in Abhängigkeit von verschiedenen Rührerdrehzahlen und Luftdurchsätzen. Der kLa-Wert steigt mit höheren Rührerdrehzahlen und Luftdurchsätzen.
Abbildung 5: Ergebnisse aus Versuch 1 für Reaktor "Grün": kLa in Abhängigkeit von verschiedenen Rührerdrehzahlen und Luftdurchsätzen. Der kLa-Wert steigt mit höheren Rührerdrehzahlen und Luftdurchsätzen.Experiment 2 (Reaktor-Reaktor-Variation)
Die in Abbildung 6 dargestellten Ergebnisse entsprechen den kLa-Werten, die mit den Reaktoren "Blau" und "Grün" ermittelt wurden. Versuch 2 wurde innerhalb von 7,3 Stunden für Reaktor "Blau" bzw. 6,3 Stunden für Reaktor "Grün" abgeschlossen. Trotz eines identischen Hardware-Layouts und Versuchsaufbaus waren die ermittelten kLa-Werte für den Reaktor "Grün" höher als für "Blau". Dieser Unterschied wurde auch bei allen anderen vorgestellten Experimenten beobachtet. Obwohl beide Reaktoren über eine identische Hardware-Ausstattung verfügten, müssen subtile und/oder unbemerkte Unterschiede bestanden haben, z. B. könnte das Einblasrohr des Reaktors "Blau" aufgrund früherer Verwendung verstopft gewesen sein.
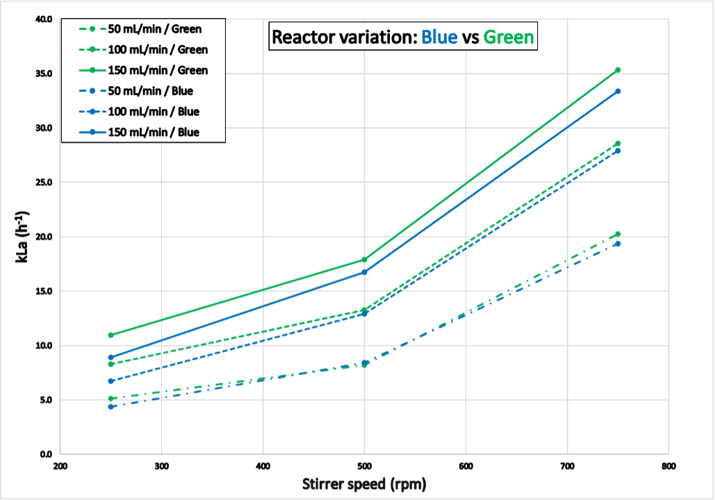 Abbildung 6: Ergebnisse aus Versuch 2 für die Reaktoren "Blau" und "Grün": Variation von Reaktor zu Reaktor. Die kLa-Werte bei ähnlichen Prozessbedingungen sind für den Reaktor "Grün" höher als für "Blau".
Abbildung 6: Ergebnisse aus Versuch 2 für die Reaktoren "Blau" und "Grün": Variation von Reaktor zu Reaktor. Die kLa-Werte bei ähnlichen Prozessbedingungen sind für den Reaktor "Grün" höher als für "Blau".Experiment 3 (Temperaturschwankungen)
Die in Abbildung 7 dargestellten Ergebnisse entsprechen den mit dem Reaktor "Grün" ermittelten kLa-Werten. Versuch 3 wurde innerhalb von 6,3 Stunden (bei 20°C) und 5,6 Stunden (bei 37°C) abgeschlossen. Bei 37°C war der Gastransfer effektiver als bei 20°C mit deutlich höheren kLa-Werten. Die Ergebnisse für den Reaktor "Blau" sind im Anhang dargestellt.
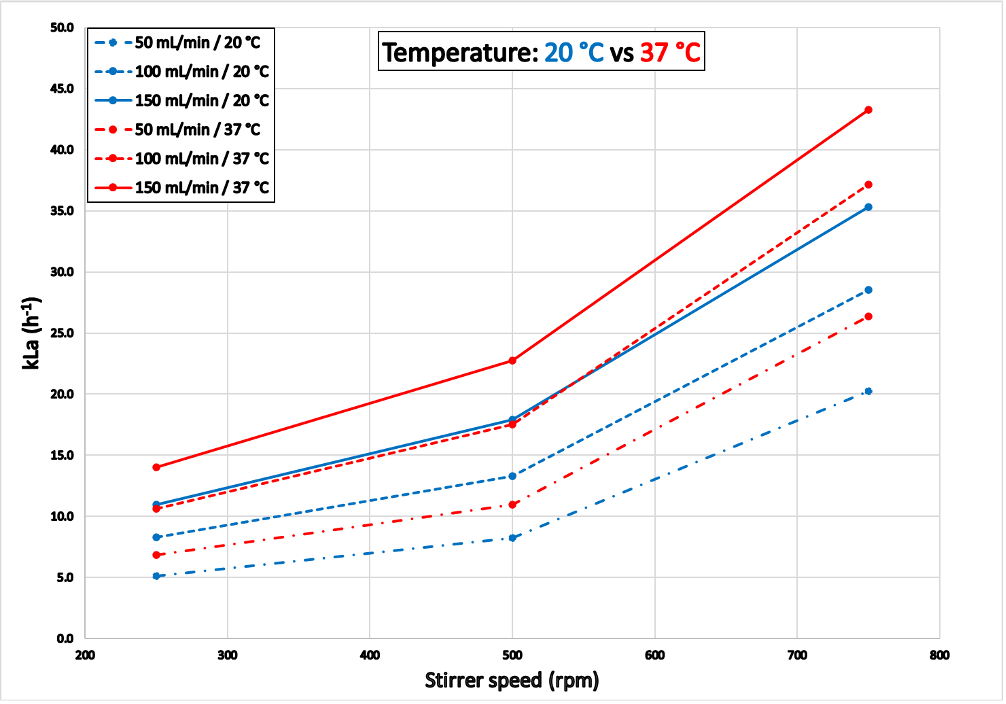
Experiment 4 (Variation der Konfiguration)
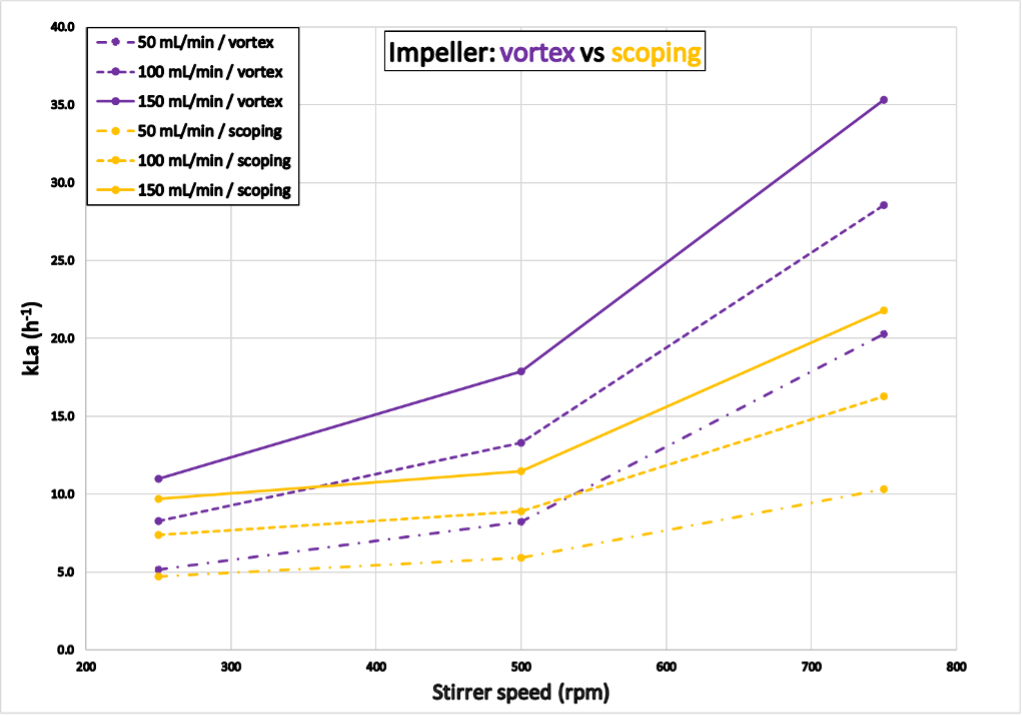
Die in Abbildung 8 dargestellten Ergebnisse entsprechen den mit dem Reaktor "Grün" ermittelten kLa-Werten. Versuch 4 wurde innerhalb von 6,3 Stunden (Vortex Impeller) und 10,3 Stunden (Scoping Impeller) abgeschlossen. Der Gastransfer war beim Vortex Impeller effektiver als beim Scoping-Impeller, was zu deutlich höheren kLa-Werten bei ersterem führte. Die Ergebnisse für den Reaktor "Blau" sind im Anhang dargestellt.
Schlussfolgerung
Die Ergebnisse zeigen das transformative Potenzial der automatisierten kLa-Bestimmungsanwendung. Die wichtigsten Vorteile sind ein deutlich reduzierter Zeitaufwand, eine verbesserte Reproduzierbarkeit und ein besseres Prozessverständnis.
Die Gesamtzeit für die Bestimmung des kLa durch den Bediener wird erheblich verkürzt. Um dies zu verdeutlichen: Mit der Lucullus®-Anwendung zur Bestimmung der kLa könnte ein Bediener bei der Durchführung von Versuch 1 (Reaktor "Grün") im Vergleich zur manuellen Durchführung desselben Versuchs beachtliche 30 bis 90 Arbeitsstunden einsparen. Berücksichtigt man die Zeit, die für die manuelle Verarbeitung der Daten und die anschließende Berechnung der kLa-Werte für die 300 Läufe benötigt wird, könnte sogar noch mehr Zeit eingespart werden. Ein Vergleich des Zeitaufwands zwischen automatisierter und manueller kLa-Bestimmung anhand des Experiments 1 (300 Läufe, Reaktor "Grün") ist in Tabelle 1 dargestellt. Selbst wenn die manuelle Durchführung des Experiments und die manuelle Bearbeitung der Rohdaten optimiert wurden, konnte durch den Einsatz der automatisierten kLa-Bestimmung eine Zeitersparnis von ca. 35 Stunden erreicht werden, was einer Aufwandsreduktion von 96% entspricht.
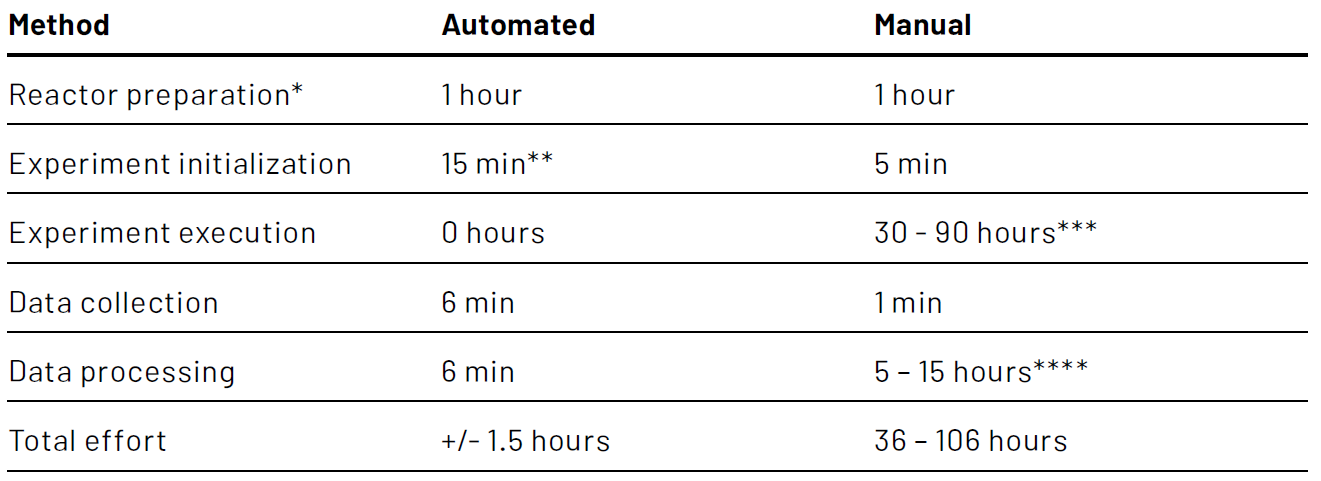
** Beinhaltet das Starten der Bioreaktorsteuerung, die Initialisierung der Lucullus®-Software, das Starten eines Prozesses in Lucullus® und die Eingabe von Werten für alle experimentellen Einstellungen in Lucullus®
*** Die durchschnittliche Zeit eines einzelnen kLa-Bestimmungslaufs für Experiment 1 betrug etwa 18 Minuten. Im optimistischsten Szenario nutzt der Bediener ein Alarmsystem, um den größten Teil der Laufzeit für andere Aufgaben zu verwenden. Im pessimistischsten Szenario überwacht der Bediener die Läufe kontinuierlich, um sicherzustellen, dass ein abgeschlossener Lauf rechtzeitig gestoppt und ein neuer gestartet wird.
**** Im optimistischsten Szenario verfügt der Bediener über eine Softwarevorlage zur automatischen Verarbeitung der Rohdaten und zur Berechnung der kLa-Werte. Im pessimistischsten Szenario hat der Bediener keine solche Vorlage zur Verfügung und verarbeitet die Daten manuell.
Die automatisierte Anwendung zur kLa-Bestimmung verbessert die Reproduzierbarkeit erheblich, da manuelle Eingriffe entfallen. Darüber hinaus erhöht die Generierung großer Datensätze die statistische Relevanz der Ergebnisse und liefert robustere und zuverlässigere kLa-Werte.
Die bei Versuch 2 festgestellte Reaktor-Reaktor-Variation zeigt die Notwendigkeit, die kLa-Werte für jedes Bioreaktorsystem einzeln zu bestimmen. Es ist falsch, davon auszugehen, dass die Reaktoren die gleichen Gasübertragungsfähigkeiten haben, selbst bei völlig identischer Hardware-Konfiguration. Die Betreiber könnten diese Erkenntnisse nutzen, um ihre Arbeitsabläufe anzupassen, indem sie die kLa-Werte über Nacht bestimmen und die am nächsten Morgen vorliegenden Ergebnisse nutzen, um die Unterschiede in der Gasübertragungseffizienz der einzelnen Bioreaktoren zu berücksichtigen und die Belüftungsstrategie anzupassen.
Die Ergebnisse aller vier durchgeführten Experimente zeigen das Potenzial, ein besseres Verständnis für die verschiedenen Faktoren zu erlangen, die die Gasübertragungseigenschaften in einem Bioreaktorsystem beeinflussen können. In Zukunft wäre es interessant, den kLa-Wert mit anderen Methoden zur kLa-Bestimmung zu ermitteln und zu untersuchen, ob ein eindeutiger Zusammenhang zwischen experimentell ermittelten kLa-Werten und Modellen zur Berechnung von kLa-Werten hergestellt werden kann.
Die Ergebnisse aller vier durchgeführten Experimente zeigen das Potenzial, ein viel besseres Verständnis aller verschiedenen Faktoren zu erlangen, die die Gasübertragungseigenschaften in einem Bioreaktorsystem beeinflussen können. In Zukunft wäre es interessant, den kLa-Wert mit anderen Methoden zur kLa-Bestimmung zu ermitteln und zu untersuchen, ob eine klare Beziehung zwischen experimentell ermittelten kLa-Werten und Modellen zur Berechnung von kLa-Werten hergestellt werden kann.
Wichtige Punkte
Die automatisierte kLa-Bestimmung mit Lucullus® ist ein leistungsfähiges neues Werkzeug zur Bestimmung der kLa-Werte von Bioreaktorsystemen, das den Anwendern viel Zeit und Mühe erspart, die Reproduzierbarkeit erhöht und große Datensätze mit statistischer Aussagekraft erzeugt. Diese Anwendung demonstriert die Fähigkeit von Lucullus®, die Ausführung verschiedener Arten von Bioprozessen erfolgreich zu automatisieren.
Referenzen
- Garcia-Ochoa, Felix, and Emilio Gomez. 2009. “Bioreactor Scale-up and Oxygen Transfer Rate in Microbial Processes: An Overview.” Biotechnology Advances 27(2):153–76. doi: https://doi.org/10.1016/j.biotechadv.2008.10.006.
- Seidel, Stefan, Rüdiger W. Maschke, Sören Werner, Valentin Jossen, and Dieter Eibl. 2021. “Oxygen Mass Transfer in Biopharmaceutical Processes: Numerical and Experimental Approaches.” Chemie Ingenieur Technik 93(1–2):42–61.
doi: https://doi.org/10.1002/cite.202000179. - Vanags, J., and A. Suleiko. 2022. “Oxygen Mass Transfer Coefficient Application in Characterisation of Bioreactors and Fermentation Processes.” Latvian Journal of Physics and Technical Sciences 59(5):21–32.
doi: https://doi.org/10.2478/lpts-2022-0038. - van’t Riet, Klaas, and Johannes Tramper. 1991. Basic Bioreactor Design. CRC Press.
- Wise, W. S. 1951. “The Measurement of the Aeration of Culture Media.” Journal of General Microbiology 5(1):167–77. doi: https://doi.org/10.1099/00221287-5-1-167.
- Das Bild in der Kopfzeile stammt von Jort Altenburg, at Animal Cell Lab, Department of Bioprocess Engineering, Wageningen University & Research
Weitere Ergebnisse der Versuche 1 - 4 sind im Anhang aufgeführt, der in der PDF-Version dieses Artikels enthalten ist. Er kann hier heruntergeladen werden (nur auf Englisch verfügbar).











