Im Vergleich zu anderen Verabreichungssystemen sind virale Verabreichungssysteme wie adeno-assoziierte Viren (AAV) gut etabliert und als Vektoren für Impfstoffe und Gentherapien zugelassen. Virale Verabreichungssysteme können zu Immunogenität und häufigeren systemischen Nebenwirkungen führen[5]. Außerdem ist der Herstellungsprozess wesentlich komplexer und für gentherapeutische Anwendungen sind hohe Titer erforderlich. Im Gegensatz dazu können für mRNA-Produktionsverfahren einfache und robuste Plattformen im Produktionsmaßstab geschaffen werden. Unternehmen können mRNA-Impfstoffe relativ schnell entwickeln, sobald sie die genetische Sequenz des Erregers kennen, und können sich so auf die Prozessentwicklung konzentrieren. COVID-19-Impfstoffe sind wahrscheinlich erst der Anfang der mRNA-Revolution. Die steigende Nachfrage nach mRNA-Impfstoffen erfordert eine Technologieplattform und ein kostengünstiges Herstellungsverfahren mit genau definierter Produktcharakterisierung.
Der mRNA-Herstellungsprozess
Die großtechnische Herstellung von mRNA-Impfstoffen besteht aus einer ein- oder zweistufigen In-vitro-Reaktion, gefolgt von einer mehrstufigen Reinigung, die DNase-Verdau, Ausfällung, Chromatographie oder Tangentialflussfiltration umfassen kann.
Herstellung einer pDNA-Vorlage
Die Linearisierung ist erforderlich, um Transkriptionsereignisse zu vermeiden, die unerwünschte Formen von mRNAs erzeugen können. Dazu wird die Plasmid-DNA mit einem Restriktionsenzym in einem Reaktionspuffer gemischt[1]. Verunreinigungen wie das Restriktionsenzym, BSA, DNA-Fragmente, Endotoxine und andere werden dann durch Tangentialflussfiltration (TFF) oder Chromatographie entfernt.
In vitro Transkription
Der nächste Schritt ist die In-vitro-Transkription, bei der linearisierte pDNA, die als DNA-Vorlage dient, in mRNA umgeschrieben wird. Bei dieser enzymatischen Reaktion werden Elemente des natürlichen Transkriptionsprozesses verwendet, darunter RNA-Polymerase und Nukleotidtriphosphate. Nach der Transkription benötigt die endgültige mRNA-Struktur eine 5'-Cap-Struktur, um stabil zu sein und in der Zelle effizient übersetzt zu werden[4].
mRNA-Reinigung
Nach dem Schritt der In-vitro-Transkription wird die mRNA von Verunreinigungen und Materialien wie Endotoxinen, immunogener doppelsträngiger RNA (dsRNA), DNA-Templat-Resten, RNA-Polymerase und elementaren Verunreinigungen gereinigt. Für die mRNA-Reinigung stehen mehrere Optionen zur Verfügung, z. B. TFF oder Chromatographieschritte, einschließlich Umkehrphasen-Ionenpaar, Anionenaustausch und Affinitätschromatographie mit Poly(dT)-Trennung[5].
Nach der Reinigung erfolgt die endgültige Konzentration und Diafiltration, um die Produktreinheit zu maximieren und die mRNA in den entsprechenden Puffer für die Formulierung oder Lagerung zu überführen.
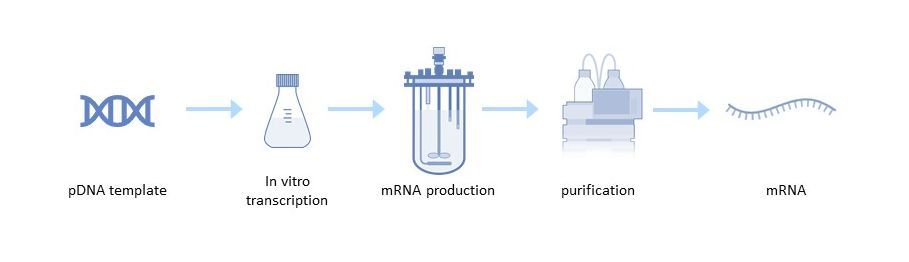
Abbildung 2: mRNA-Produktionsprozess
Lipid-Nanopartikel (LNP)
Ebenso wichtig für die Wirksamkeit von mRNA-Impfstoffen und -Therapeutika sind die Transportmittel. Lipid-Nanopartikel (LNP) werden am häufigsten für die mRNA-Übertragung verwendet. Jeder Lipid-Nanopartikel besteht aus vier verschiedenen Lipiden, die den Transport der mRNA im Inneren ermöglichen und sie vor dem Abbau schützen. Diese Lipide sind auch für die effiziente Freisetzung der RNA in das Zytoplasma verantwortlich. Die Struktur der kationischen Lipide hat einen großen Einfluss auf die Aktivität der LNP, ihre Toxizität und Biodistribution, was wiederum die potenziellen toxischen Wirkungen im Körper beeinflusst[6]. Um mit der endgültigen Formulierung reproduzierbare Ergebnisse zu erzielen, ist eine gleichbleibende Qualität der Lipide erforderlich, die von der Qualität der für die Synthese der Lipide verwendeten Rohstoffe und den entsprechenden Materialeigenschaften des Lipids selbst abhängt.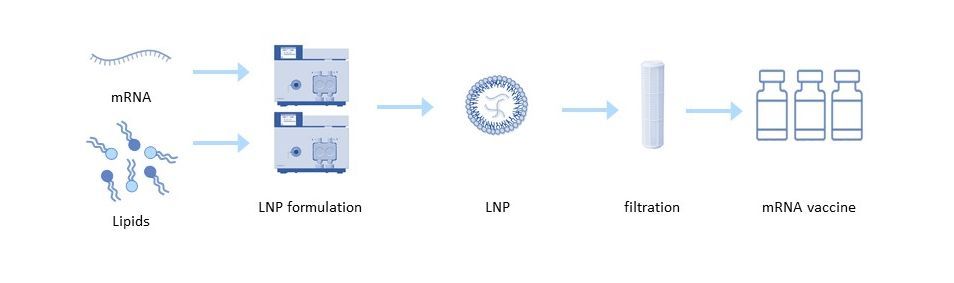
Die gereinigte mRNA kann mit verschiedenen Techniken in das Verabreichungspartikel formuliert werden. Bei der üblichen Lösungsmittelinjektionstechnik werden die Lipide in einem Lösungsmittel wie Ethanol gelöst und schnell in einen wässrigen Puffer mit niedrigem pH-Wert, der die mRNA enthält, gemischt. Der Puffer mit niedrigem pH-Wert wird dann in einen neutralen Puffer diafiltriert, wobei die Partikel durch Ultrafiltration konzentriert werden[5].
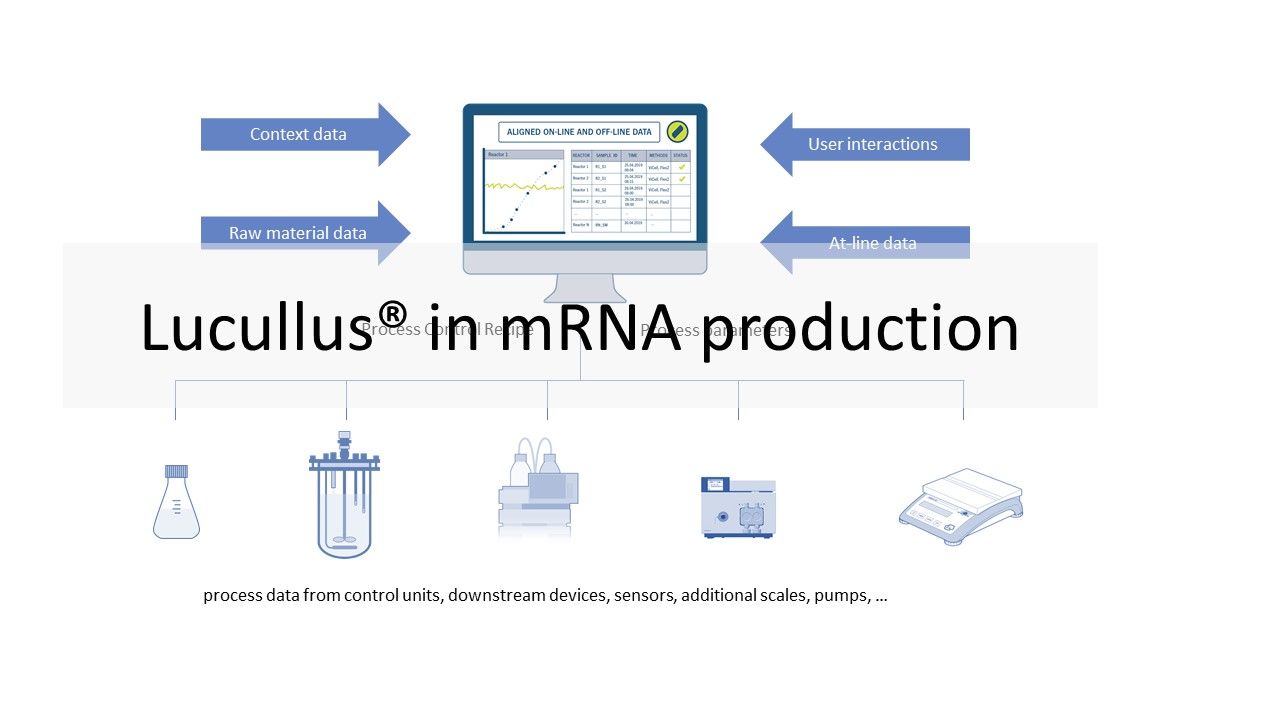
Prozessüberwachung und -steuerung mit Lucullus®
Für die einzelnen oben beschriebenen Prozessschritte werden unterschiedliche Geräte eingesetzt. Diese reichen von einfachen Sensoren, Waagen und Pumpen bis hin zu Bioreaktorkontroll- und Chromatographiesystemen. Diese Geräte stammen in der Regel von verschiedenen Herstellern. Unterschiedliche Modelle von Geräten erhöhen die Komplexität einer Anlage. Das Ziel vieler Hersteller ist es, Daten von allen Geräten in jedem Prozessschritt zu sammeln und sie in einer einzigen Datenbank zur Überwachung und Überprüfung zu speichern. Bei bestimmten Betriebseinheiten (z. B. USP-Bioreaktor, LNP-Formulierung) wollen die Hersteller die Prozesse auch automatisieren und fernsteuern. Da die Software in einer GMP-Umgebung betrieben wird, muss sie validiert werden. Der Hersteller muss also die erforderlichen IQ/OQ-Tests durchführen und die erforderliche Dokumentation vorlegen. Das Lucullus® Process Information Management System (Securecell AG, Schweiz), dessen erste Version 1995 auf den Markt kam, ist eine hochentwickelte und umfassende zentrale Datendrehscheibe für die Verwaltung und Kontrolle von Bioprozessen. Lucullus® bietet eine übergreifende, flexible und wissenschaftlerfreundliche SCADA-Funktionalität. Es ist als zentralisierte Datenerfassungs-, Überwachungs- und Steuerungsplattform für die vor- und nachgelagerte Entwicklung konzipiert, um Aktivitäten auf einer Interaktions- und Steuerungsebene zu harmonisieren, die über die der einzelnen Geräte hinausgeht.
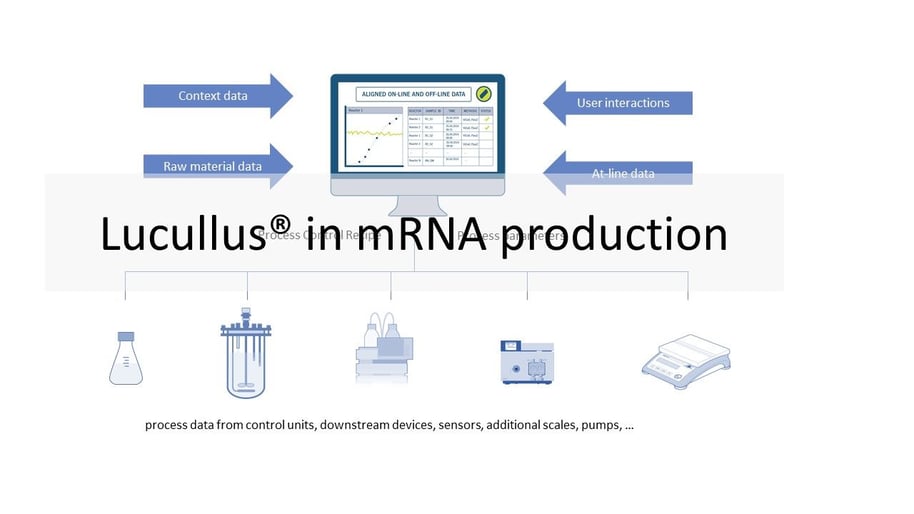
Die geräteunabhängige und modulare Architektur von Lucullus bietet die Flexibilität, Geräte verschiedener Hersteller und mit unterschiedlichen Datenschnittstellen zu integrieren und alle Aufgaben der Prozessautomatisierung zu übernehmen. Online-Gerätedaten (von den Prozesseinheiten) werden mit probenbasierten Ergebnissen aus der At- oder Offline-Analytik zusammengeführt und können auch zur Prozesssteuerung verwendet werden. Die integrierte Medienverwaltung ermöglicht die Digitalisierung von Aktivitäten in der Medienküche (Puffer, Zuführung, Bulk-Medien) und bietet gleichzeitig einen sauberen Arbeitsablauf für die Verknüpfung von Medienvorbereitungsaufzeichnungen mit Prozesseinheiten, um die Rückverfolgbarkeit von Rohmaterial und Prozessergebnissen zu gewährleisten. In Kombination mit Securecells PAT-System Numera® deckt Lucullus® die gesamte Probenplanung, das Triggern von Proben und die Verarbeitung von Online- und Offline-Daten von allen analytischen Instrumenten ab. Securecell bietet mit Lucullus® eine leistungsstarke und vielseitige Lösung, um Kunden im Bereich der mRNA-Produktentwicklung und -produktion mit den neuesten Technologien der Digitalisierung des Bioprozesses zu unterstützen.
Referenzen
- Pardi, N., Hogan, M., Porter, F. et al. mRNA vaccines — a new era in vaccinology. Nat Rev Drug Discov 17, 261–279 (2018). https://doi.org/10.1038/nrd.2017.243
- Sartorius AG. The Next Generation of Vaccines Therapies – mRNA Vaccines. www.sartorius.com, 2022. [Internet]
- Rosa SS, Prazeres DMF, Azevedo AM, Marques MPC. mRNA vaccines manufacturing: Challenges and bottlenecks. Vaccine. 2021 Apr 15;39(16):2190-2200. doi: 10.1016/j.vaccine.2021.03.038.
- Sara Sousa Rosa, Duarte M.F. Prazeres, Ana M. Azevedo, and Marco P.C. Marques. mRNA vaccines manufacturing: Challenges and bottlenecks. Vaccine. 2021 Apr 15; 39(16): 2190–2200
- Laurens Vergauwen, Dr. Nargisse El Hajjami, Mag. Manuel Brantner, Dr. Shiksha Mantri and Bahar Cebi. Manufacturing Strategies for mRNA Vaccines and Therapeutics. BioProcess Online. [Internet]
- Bancel S, Issa J, Aunins J. Ribonucleic acid purification (Patent No. WO2014152031A1). [Internet]