Herstellung von Bioethanol
Die wachsende Nachfrage nach flüssigen Verkehrskraftstoffen und die Besorgnis über den Klimawandel, der durch die Treibhausgasemissionen aus der Nutzung fossiler Brennstoffe verursacht wird, sind zu einer der größten Herausforderungen für die moderne Gesellschaft geworden. Die Erzeugung von Biokraftstoffen aus Biomasse ist eine nachhaltige Lösung, die den Verbrauch fossiler Brennstoffe erheblich verringern könnte (Herrera, 2006). Die Hefe, S. cerevisiae, ist ein hervorragender Wirtsmikroorganismus und eine weit verbreitete Zellfabrik für die biomassebasierte Produktion von Kraftstoffen und Chemikalien, insbesondere Ethanol. Übliche Substrate, die S. cerevisiae bei der industriellen Produktion von Ethanol verwendet, sind Hexosezucker wie Saccharose, Glucose oder Fructose (Abbildung 1). Diese Substrate werden meist aus Zuckerrüben in Europa, Zuckerrohr in Südamerika oder Mais in Indien und den Vereinigten Staaten gewonnen (Kang & Lee, 2015). Da diese so genannten Rohstoffe der ersten Generation das Potenzial haben, als wertvolle Nahrungsquelle zu dienen und die Abholzung der Wälder und die Artenvielfalt zu beeinflussen, ergeben sich ethische Überlegungen, wenn sie für die Ethanolproduktion verwendet werden (Paravantis, 2022). cEs besteht ein großes Interesse an der Umstellung auf alternative Rohstoffe wie Abfallströme aus der landwirtschaftlichen Produktion, die als Rohstoffe der zweiten Generation gelten. Ähnlich wie die Rohstoffe der ersten Generation sind die Rohstoffe der zweiten Generation relativ reich an Hexosezuckern. Darüber hinaus enthalten sie aber auch erhebliche Mengen an Pentosezuckern wie Xylose und Arabinose. Die Herstellung von Ethanol aus diesen Pentosezuckern wäre sowohl aus sozialer als auch aus wirtschaftlicher Sicht interessant. Wenn S. cerevisiae während der Kultivierung mit Hexose- und Pentosezuckern in Berührung kommt, verwertet die Hefe die Hexosen schnell, während sie die Pentosezucker nur langsam verbraucht. Um Biokraftstoffe kosteneffizient aus pflanzlicher Biomasse herzustellen, müssen alle Zucker, einschließlich aller Pentose- und Hexosezucker, die im Ausgangsmaterial vorhanden sind, effizient in die Endprodukte umgewandelt werden.
Die Entwicklung eines Hefestamms, der Pentose- und Hexosezucker effizient verwertet, ist seit mehreren Jahrzehnten Gegenstand intensiver Forschung. In einer Studie, die einen evolutionären Ansatz verfolgte, wurden vielversprechende Ergebnisse erzielt. Anhand eines gentechnisch veränderten S. cerevisiae-Stammes, der in der Lage ist, Pentosezucker zu verstoffwechseln, wurde untersucht, ob ein evolutionärer Ansatz zur Entwicklung verbesserter Stämme mit verbessertem Pentosezuckerverbrauch führen könnte. Vor dem evolutionären Experiment hatte der Stamm eine Generationszeit von mehreren Tagen. Dieser Stamm wurde in Schüttelkolben beimpft, die ein Medium enthielten, das nur Pentosezucker als Kohlenstoffquelle enthielt. Immer, wenn die Kultur eine hohe Zelldichte erreichte, wurde ein Teil der Kultur in einen neuen Schüttelkolben übertragen. Nach mehrmaliger Wiederholung dieses Wachstums- und Transferprozesses wurde schließlich ein entwickelter Stamm mit einer Generationszeit von weniger als einem Tag erhalten. Der entwickelte Stamm wurde einer Ganzgenomsequenzierung unterzogen, und es wurde eine einzelne Aminosäuremutation in einem Hexose-Transporter nachgewiesen. Der weiterentwickelte Stamm zeigte verbesserte Xylose-Aufnahmeraten sowie eine teilweise gemeinsame Nutzung von Glucose und Xylose in Mischzuckerkulturen (Reider Apel et al., 2016). Die Fähigkeit dieses Stammes, sowohl Glukose als auch Xylose mit vergleichbaren Raten zu verwerten, ist eine sehr wichtige Eigenschaft für die effiziente und industrielle Produktion von Ethanol aus Rohstoffen der zweiten Generation.
"Mit der Lucullus®-Software sind wir in der Lage, mikrobielle Kulturen über lange Zeiträume mit komplexen Fütterungsroutinen zu kultivieren. Um eine optimale Kontrolle der Kulturparameter zu gewährleisten und den manuellen Arbeitsaufwand zu minimieren, ist eine zuverlässige und anpassungsfähige Software zur Kulturautomatisierung unerlässlich. Unsere Erfahrungen mit der Lucullus®-Software sind sehr positiv, und wir haben ausgezeichnete Unterstützung bei der Anpassung der Funktionen an unsere Bedürfnisse erhalten."

Automatisierte Experimente der Evolutionstechnik
Im vorherigen Beispiel wurden die Zellen in Schüttelkolben kultiviert. Für die Automatisierung von Experimenten der Evolutionstechnik sind Kultivierungen in Bioreaktorsystemen besser geeignet, da die lokale Umgebung viel genauer kontrolliert werden kann und somit die Prozessbedingungen besser definiert und Kontrollaufgaben automatisiert werden können. Da der Aufbau eines Bioreaktorexperiments komplexer ist als der Aufbau eines Schüttelkolbenexperiments, wurde ein Protokoll geschrieben, das einen generischen Aufbau für automatisierte Evolutionsexperimente unter Verwendung von Getinge Applikon Bioreaktorsystemen in Kombination mit der Prozessinformationsmanagementsoftware Lucullus® beschreibt (de Hulster et al., 2022).
Der Materialbedarf für Experimente des Evolution Engineering hängt vom Zielstamm, dem gewünschten Evolutionsergebnis und den Selektionsbedingungen in der Kultur ab. Abbildung 2 zeigt eine schematische Darstellung des Bioreaktoraufbaus, der für die automatisierten Evolutionstechnik-Experimente mit aeroben und anaeroben Kulturen von S. cerevisiae mit einer Vielzahl von Kohlenstoffquellen als wachstumslimitierende Nährstoffe verwendet wurde. Der Aufbau bestand aus (1) einem autoklavierbaren Bioreaktor, (2) einem elektronischen Flüssigkeitsstandssensor, (3) einem Mediumeinlass, (4) einem Abflussrohr in der Nähe des Reaktorbodens, (5) einem Mediumreservoir, das mit einer steuerbaren Pumpe an den Bioreaktor angeschlossen war, (6) einen Abfallbehälter, der mit einer steuerbaren Pumpe an den Bioreaktor angeschlossen ist, (7) eine Druckgasleitung mit Massendurchflussregler (MFC) und (8) eine Lucullus®-Steuerungssoftware für die Automatisierung des Aufbaus während des evolutionären Engineering-Experiments.
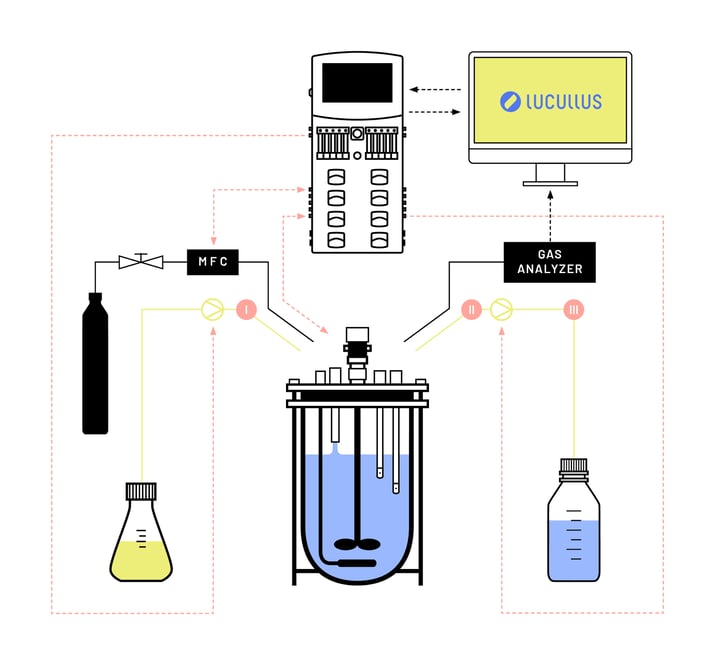
Sequentielle Batch-Kulturen
Es gibt verschiedene Kultivierungsstrategien für Experimente der Evolutionstechnik, nämlich die sequentielle Batch-Kultivierung, die Chemostat-Kultivierung und die Accelerostat-Kultivierung. Die verschiedenen Kultivierungsstrategien werden in der folgenden Abhandlung ausführlich beschrieben: Under Pressure Evolutionary Engineering of Yeast Strains for Improved Performance in Fuels and Chemicals Productions (Mans et al., 2018). In diesem Artikel wird das Konzept der evolutionären Technik für sequenzielle Batch-Kultivierungen (wiederholte Batches) beschrieben.
Der Bediener beginnt mit der Vorbereitung der Materialien für das automatisierte evolutionäre Engineering-Experiment (Abbildung 2). Der vorbereitete Bioreaktor wird mit der ersten Charge beimpft. Diese erste Charge ist normalerweise nicht repräsentativ in Bezug auf die Chargenzeit und andere Prozesswerte (Abbildung 3A). Nach der ersten, nicht repräsentativen Charge erfolgt die Entleerung und Wiederbefüllung des Reaktors manuell. Anschließend wird der Reaktor mit der zweiten Charge geimpft. Nach der zweiten Charge wird die Chargenzeit bestimmt (20 h), der höchste CO2-Wert des Ausflusses (blaue Linie; ein Indikator für die Anzahl der Zellen im Bioreaktor) gemessen (0,46 %) und der kumulative CO2-Gehalt (orange Linie; ein willkürlicher Wert, der angibt, wie viel des Kohlenstoffsubstrats verbraucht wurde) berechnet (3,1) (Abbildung 3B). Diese drei Prozesswerte werden verwendet, um die Schwellenwerte für die automatischen Entleerungs- und Wiederbefüllungszyklen in der Lucullus®-Software festzulegen. Zum Schutz vor unbeabsichtigten Entleerungs-/Nachfüllungszyklen werden Kontrollpunkte für die Chargenzeit, die Abnahme des CO2-Niveaus im Ausfluss und das kumulative CO2-Niveau festgelegt (Abbildung 3C).
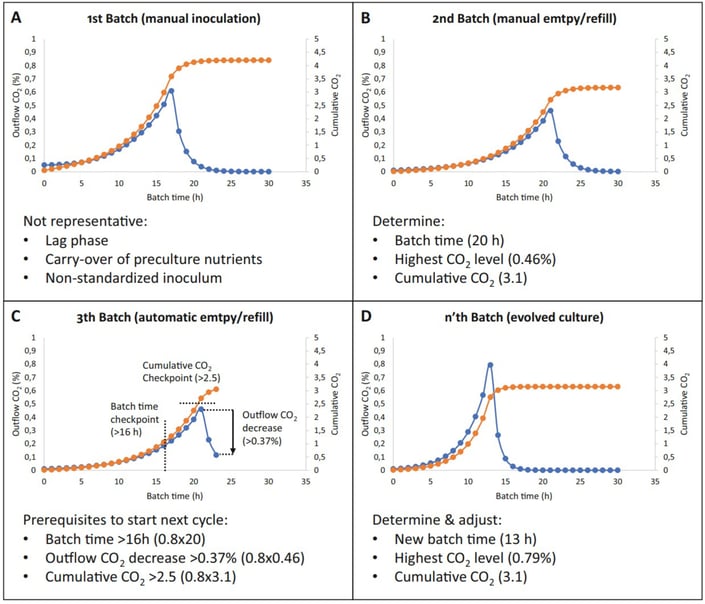
Die Vermeidung von unbeabsichtigten Leer-/Nachfüllzyklen ist wichtig, da der Verlust eines erheblichen Teils der Population die automatische Entwicklung stören könnte. Nachdem diese Schwellenwerte in der Software Lucullus® festgelegt wurden, kann der sequenzielle Batch-Prozess selbständig ablaufen. Im Laufe der Zeit entwickelt sich die Kultur, d. h. die Chargenzeit, der höchste CO2-Wert des Ausflusses und die kumulative Höhe der CO2-Veränderung (Abbildung 3D). In regelmäßigen Abständen müssen diese Schwellenwerte angepasst werden, um sicherzustellen, dass die Entleerungs-/Nachfüllzyklen immer noch zum richtigen Zeitpunkt ausgelöst werden, was für die Weiterentwicklung der Kultur von grundlegender Bedeutung ist.
Software Lucullus®
Das Lucullus® Process Information Management System ist eine umfassende Software für die Bioprozessautomatisierung. Neben grundlegenden SCADA-Funktionen, die eine Geräteüberwachung und -steuerung von über 100 Geräten in typischen Bioprozessumgebungen ermöglichen, verfügt Lucullus® über eine integrierte Proben- und Rohstoffmanagementfunktionalität sowie über Schnittstellen zu verschiedenen LIMS- und ELN-Systemen und Statistiksoftwarepaketen wie Phyton, MATLAB und DataHowLab.
Sequentielle Batch-Kulturen mit Lucullus®
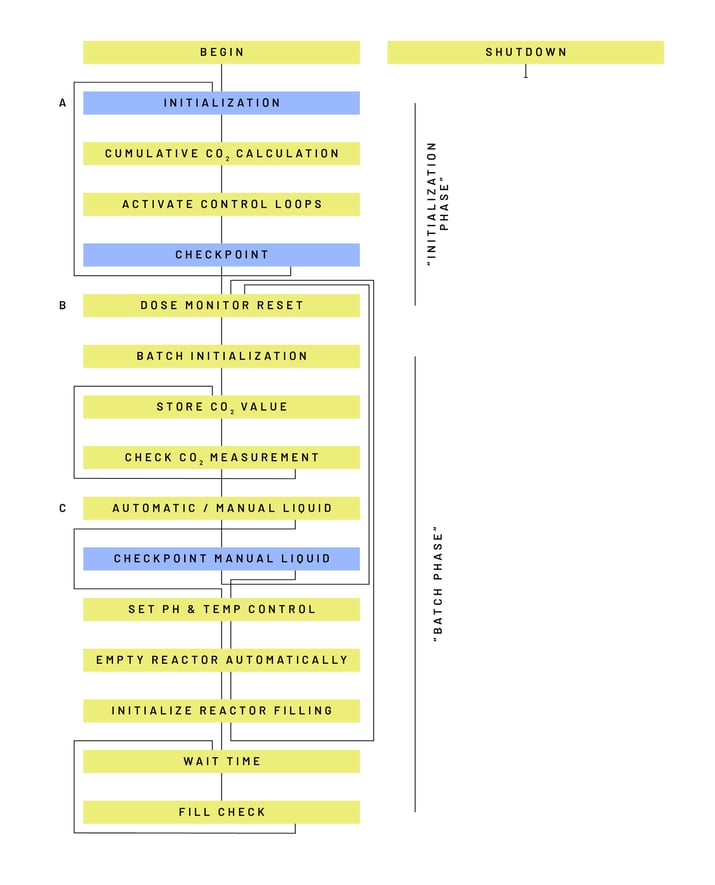
Forscher der TU Delft nutzten Lucullus® zur Automatisierung und Digitalisierung ihrer Experimente in der Evolutionstechnik. Abbildung 4 zeigt eine schematische Darstellung der Operation oder der Schrittkette/des Prozessrezepts, die zur Automatisierung des Repeated Batch-Experiments verwendet wurden. Die Operation führt den Bediener durch die Einrichtung des Prozesses mit manuellen Interaktionsschritten (blaue Blöcke) und führt anschließend den Großteil des Prozesses selbständig aus (gelbe Blöcke).
Erläuterung der wiederholten Stapelverarbeitung
Die einzelnen Schritte der in Abbildung 4 dargestellten Schrittkette setzen sich aus den folgenden Funktionen zusammen:
- Beginnen: Standardschritt ohne Befehle, der zu Beginn eines jeden Prozesses ausgeführt wird
- Initialisierung: Schritt der Benutzerinteraktion, Überprüfung/Anpassung kritischer Prozessparameterwerte
- Kumulative CO2-Berechnung: Schritt der Formeldefinition, der die kumulative Menge des im Bioreaktor erzeugten CO2 berechnet
- Aktivieren der Regelkreise: Regleraktivierungsschritt, Start pH-Wert, Rührer und Temperaturregelung
- Kontrollpunkt: Schritt der Benutzerinteraktion, bei dem geprüft wird, ob mit dem Schritt "Zurücksetzen des Dosismonitors" fortgefahren oder zum Schritt "Initialisierung" zurückgekehrt werden soll
- Dosisüberwachung zurücksetzen: Schritt, Zurücksetzen der Totalisatorwerte der Gasfluss-, Säure- und Basenpumpen
- Chargeninitialisierung: Schritt, bei dem die (erste oder eine der aufeinanderfolgenden) Chargenkulturen gestartet wird
- CO2-Wert speichern: Schritt, Speichern des Wertes der CO2-Abgasmessung für den späteren Wertevergleich (siehe Schritt CO2-Messungen prüfen)
- CO2-Messungen überprüfen: Schritt, bei dem der aktuelle CO2-Wert mit dem zuvor gespeicherten Wert verglichen wird. Schleift wiederholt zurück, bis das Ende der Charge erreicht ist
- Automatisch / Manuelles Liquid Cycling: Schritt, der Lucullus® zu einem automatisierten oder manuell durchgeführten Medienwechsel führt
- Checkpoint Manual Liquid Cycling: Schritt, der es dem Benutzer ermöglicht, den Abschluss eines manuellen Medienwechsels zu bestätigen oder zu einem automatischen Medienwechsel zu wechseln
- pH & Temp Control: pH- und Temperaturregelungsschritt, Aktivierung oder Deaktivierung der pH- und Temperaturregelkreise, wie vom Benutzer während der Initialisierung ausgewählt
- Automatisches Entleeren des Reaktors: Erntestufe, automatische Entleerung des Reaktors durch die Erntepumpe, basierend auf einer vordefinierten Pumpzeitaktivität, die vom Benutzer während der Initialisierung ausgewählt wurde
- Initialisierung der Reaktorbefüllung: Nachfüllschritt, bei dem dem Reaktor frisches Medium über die Förderpumpe zugeführt wird
- Wartezeit: Warteschritt von 6 Sekunden, der für den Schritt "Fill Check" erforderlich ist
- Füllstandskontrolle: Schritt zur Überprüfung des Füllstands im Bioreaktor. Kann wiederholt zum vorherigen Schritt zurückkehren.
Ein Beispiel für einen manuellen Benutzerinteraktionsschritt aus der wiederholten Stapelverarbeitung (Abbildung 4) ist in Abbildung 5 dargestellt. Ein Pop-up-Fenster kennzeichnet den Schritt der manuellen Interaktion. In diesem Fenster sieht der Bediener eine Liste von Parametern, die mit "Name" bezeichnet sind. Jeder Parameter kann mit einer wissenschaftlichen Einheit ("Unit") verknüpft werden. Zur Unterstützung des Bedieners kann für jeden Parameter eine Beschreibung ("Beschreibung") sowie ein zulässiger Wertebereich ("Bereich") angegeben werden. Die jedem Parameter zugewiesenen Standardprozesswerte können vor dem Start des Prozesses geändert werden ("Default").
 Abbildung 5: Beispiel für den manuellen Interaktionsschritt "Initialisierung" im Rahmen der wiederholten Stapelverarbeitung.
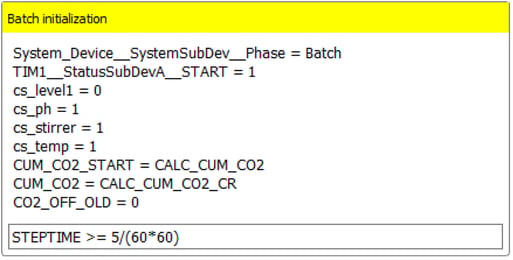
Abbildung 5: Beispiel für den manuellen Interaktionsschritt "Initialisierung" im Rahmen der wiederholten Stapelverarbeitung.Während des Prozesses signalisiert Lucullus® die aktuelle Ausführungsphase durch Prozessindikatoren, die so genannten "Phases". In Abbildung 6 ist ein Ausschnitt aus dem Schritt "Batch Initialization" des Repeated Batch Operation dargestellt, der den Beginn der Batch-Phase markiert. Sobald die Batch-Phase einen Punkt erreicht hat, an dem die Kriterien für die Beendigung erfüllt sind (siehe Schritt "Check CO2 Measurements"), fährt Lucullus ® mit dem Schritt "Empty Reactor Automatically" fort, sofern sich der Benutzer nicht zuvor für einen manuellen Mediumwechsel entschieden hat (Abbildung 4). Auf den Schritt "Reaktor automatisch entleeren" folgt der Schritt "Reaktor automatisch befüllen", woraufhin eine weitere Batchphase gestartet wird.
Ein wesentlicher Bestandteil des Repeated Batch-Betriebs ist die Überwachung des CO2-Gehalts im Abgas. Durch die Programmierung einer Schleife, die aus zwei miteinander verbundenen Schritten besteht, verfolgt Lucullus® den höchsten aufgezeichneten CO2-Wert für eine bestimmte Charge. Die zweistufige Schleife ist in Abbildung 7.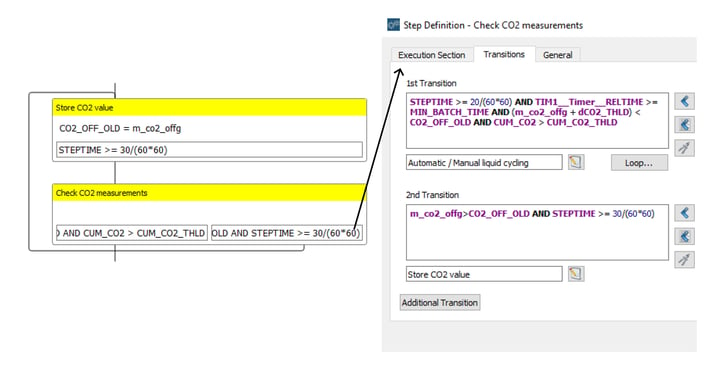
Wenn eine Charge abgeschlossen ist, muss der größte Teil der Fermentationsbrühe entfernt (geerntet) werden. Ein kleines Flüssigkeitsvolumen, das nach der Entnahme im Bioreaktor verbleibt, dient als Inokulum für die nächste Charge. Der Bediener kann wählen, ob der Bioreaktor manuell oder automatisch entleert und wieder befüllt werden soll. Im zweiten Fall ist Lucullus® so programmiert, dass er die Ernte und das Wiederauffüllen in zwei aufeinander folgenden Schritten durchführt (Abbildung 8).

Lucullus® beendet automatisch alle aktiven Regelkreise und Aktoren, wenn ein Experiment beendet ist. Diese Funktionalität ist in Abbildung 9 dargestellt.

Zugehöriges Webinar
Dieser Artikel wurde in einem Webinar vorgestellt. Um die aufgezeichnete Version dieses Webinars anzusehen, folgen Sie bitte diesem Link (nur auf Englisch)
Referenzen
-
(de Hulster, E., Mooiman, C., Timmermans, R., & Mans, R. (2022). Automated Evolutionary Engineering of Yeasts. In V. Mapelli & M. Bettiga (Eds.), Yeast Metabolic Engineering: Methods and Protocols (pp. 255–270). Springer US.https://doi.org/10.1007/978-1-0716-2399-2_15
-
Dragosits, M., & Mattanovich, D. (2013). Adaptive laboratory evolution – principles and applications for biotechnology. Microbial Cell Factories, 12(1), 64. https://doi.org/10.1186/1475-2859-12-64
-
Herrera, S. (2006). Bonkers about biofuels. Nature Biotechnology, 24(7), 755–760. https://doi.org/10.1038/nbt0706-755
-
Kang, A., & Lee, T. S. (2015). Converting Sugars to Biofuels: Ethanol and Beyond. Bioengineering, 2(4), 184–203. https://doi.org/10.3390/bioengineering2040184
-
Mans, R., Daran, J.-M. G., & Pronk, J. T. (2018). Under pressure: evolutionary engineering of yeast strains for improved performance in fuels and chemicals production. Current Opinion in Biotechnology, 50, 47–56. https://doi.org/https://doi.org/10.1016/j.copbio.2017.10.011
-
Paravantis, J. A. (2022). 38 - Socioeconomic aspects of third-generation biofuels. In E. Jacob-Lopes, L. Q. Zepka, I. A. Severo, & M. M. Maroneze (Eds.), 3rd Generation Biofuels (pp. 869–917). Woodhead Publishing.https://doi.org/https://doi.org/10.1016/B978-0-323-90971-6.00046-2
-
Reider Apel, A., Ouellet, M., Szmidt-Middleton, H., Keasling, J. D., & Mukhopadhyay, A. (2016). Evolved hexose transporter enhances xylose uptake and glucose/xylose co-utilization in Saccharomyces cerevisiae. Scientific Reports, 6(1), 19512. https://doi.org/10.1038/srep19512
-
Stovicek, V., Holkenbrink, C., & Borodina, I. (2017). CRISPR/Cas system for yeast genome engineering: advances and applications. FEMS Yeast Research, 17(5), fox030. https://doi.org/10.1093/femsyr/fox030











